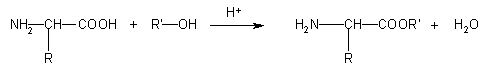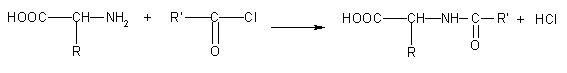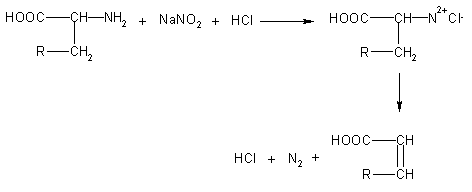AMINOACIDI E PROTEINE
Introduzione
La fondamentale
importanza delle proteine non è in discussione, attraverso queste molecole le cellule
svolgono tutte le proprie funzioni. Le proteine sono molecole di grandi
dimensioni e di elevato peso molecolare, la struttura è però molto simile sono
venti aminoacidi che combinandosi in maniera differente modificano il
significato della molecola. Le proteine svolgono numerose funzioni ad esempio enzimi
che svolgono funzioni non importanti ma fondamentali per la vita e l’equilibrio
della cellula stessa. Gli enzimi sono catalizzatori biologici, ovvero
facilitano le reazioni abbassando l’energia di attivazione e aumentando la
velocità di reazione. Le proteine sono dei mediatori chimici,
ovvero modulano i segnali che le cellule si trasmettono, gli anticorpi
che regolano la reazione dell’organismo quando entrano sostanze estranee, le
proteine formano la struttura degli organi, della membrana
cellulare, sono dei mezzi di trasporto di molecole all’interno e all’esterno
della cellula. Molte proteine svolgono un azione contrattile e
quindi favoriscono il movimento degli organismi inferiori. Costituiscono materiali
di deposito servono a nutrire gli embrioni animali e
vegetali, ormoni svolgono un azione importante per l’organismo
tipo la regolazione del glucosio.
Chimica
degli aminoacidi
Sono in numero di
20 tutti possiedono l gruppo amminico e acido. Si suddividono in aminoacidi non
polari, polari, acidi e basici. Si suddividono ancora in aminoacidi essenziali
e non essenziali. Gli aminoacidi presenti nelle proteine
appartengono alla serie L infatti molti aminoacidi presentano l’ atomo di
carbonio alfa asimmetrico, si parla
della isomeria ottica e di tutto quello che si è detto per gli zuccheri. Le due
forme speculari vengono indicate come isomero D e L . Vi sono anche aminoacidi diversi ovvero la 6 N
metillisina, la 4 idrossiprolina, la 5 idrossilisina.
La presenza di
gruppi acidi e basici contemporaneamente nella molecola causa fenomeni
particolari, possono polarizzarsi entrambi i gruppi oppure solo uno dei due. Il
grado di ionizzazione dipende dal pH e possono essere dipoli oppure no. Il
valore di pH dove si forma il dipolo viene chiamato pI punto isoelettrico. I
gruppi funzionali sono deboli il calcolo del pI è dato dalla somma dei due
valori di pK diviso per due.
PI = pK1 + pK2 / 2
Il grado di ionizzazione dei gruppi acidi e basici è legato al pH della soluzione con la seguente formula:
pH = pKa + log conc
base coniugata/ conc acido coniugato
Reazioni
degli aminoacidi
Le reazioni
riguardano i gruppi acidi e basici. Si possono avere le seguenti reazioni:
1)
reazione con alcoli
|
|
|
2)
reazione con alogenuri alchilici,
|
|
|
3)
reazione con nitrito di sodio
|
|
|
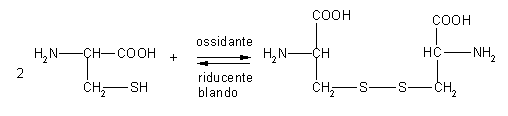
4)
reazione con ossidanti blandi
|
|
|
5)
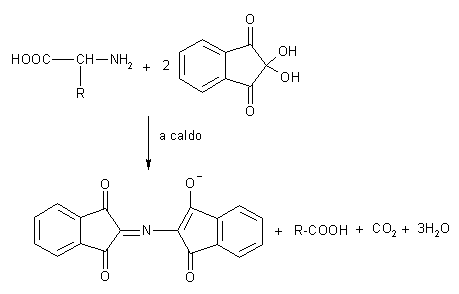
con ninidrina è una reazione di
riconoscimento, reazione molto sensibile, bastano solo pochi mg di aminoacido per
dare la reazione. La colorazione è caratteristica per gli aminoacidi ed è di
color marrone. Con il reattivo di Fehling diluito al 0,5% di solfato di rame
penta idrato e una soluzione al 2% di idrossido di sodio, non reagiscono gli
zuccheri ma bensì le proteine.
|
|
|
Peptidi
Una delle
importanti caratteristiche degli aminoacidi è la reazione tra il gruppo acido e
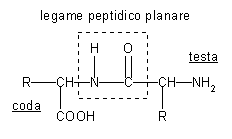
amminico di due differenti aminoacidi, per formare il legame ammidico. Questo
dimero che si viene a formare si chiama dipeptide. Il gruppo amminico ed il
gruppo carbossilico sono i due terminali.
La nomenclatura dei dipeptidi è quella di mettere il nome del primo
aminoacido seguito dal nome del secondo aminoacido esempio valilvalina oppure
cisteilcisteina. Dal modello spaziale di questi composti si può notare che il
legame peptidico è una struttura planare, gli snodi ruotano liberamente intorno
ai carboni ibridati sp3. Vengono così a crearsi delle strutture
tridimensionali dove i piano vengono ad essere traslati rispetto al legame.
|
|
|
Proprietà
acido base
Tutti gli aminoacidi abbiamo detto hanno il gruppo acido e basico che sono deboli ovvero poco dissociati. Questi gruppi concorrono alla formazioni di gruppi ionizzati dove una volta è presente la carica positiva altre volte la carica negativa. Vi è un valore di pH dove sono presenti entrambi le cariche quel valore viene detto punto isoelettrico. La ionizzazione degli aminoacidi dipende dal valore del pH, su questa caratteristica sono basate le analisi di separazione degli aminoacidi.
Struttura
delle proteine
Le proteine sono
dei polimeri naturali, formati dalle unità elementari che sono gli aminoacidi,
legati con legami peptidici. La proteina viene ad assumere una struttura
tridimensionale che è una sua caratteristica, non solo estetica ma bensì
funzionale. Una temperatura troppo elevata, un pH troppo alto, la presenza di
sali può determinare nella proteina una perdita della struttura
tridimensionale. Il processo a cui va incontro la proteina si chiama di denaturazione. Molte volte questo processo è irreversibile,
ma per taluni polimeri questo processo è reversibile. La reazione inversa si
chiama di rinaturazione. Quando si lavora con una molecola proteica si
deve lavorare sempre lontano dalle condizioni di denaturazione perché la molecola
perde le sue proprietà.
Le proteine
presentano quattro gradi di struttura.
1.
struttura primaria è l’ordine con cui gli
aminoacidi si susseguono ovvero la sequenza aminoacidica. Quindi i milioni di proteine
sono formate sempre dai venti aminoacidi, però l’ordine di successione è
diverso per cui la struttura primaria è diversa.
2.
la struttura secondaria è data dai legami ad idrogeno e dalle forze di attrazione
elettrostatica. In questo modo tratti della proteina tendono ad avvicinarsi
conferendo al polimero una forma particolare. I legami ad idrogeno avvengono
tra il gruppo carbossile e amminico. Si possono individuare due tipi di
struttura secondaria una detta ad alfa elica e l’altra a foglietto beta.
La prima struttura consiste in un
ripiegamento elicoidale della struttura che si presentano come spiralizzato
intorno ad un asse centrale, i legami ad idrogeno avvengono sui gruppi non
lineari ma sfalsati di un piano. L’alfa elica è sempre destrogira, anche se c’è
un elica levogira. Per avere questa struttura essendo i gruppi aminoacidi
vicini, l’ingombro sterico gioca un ruolo importante; infatti la presenza di
prolina impedisce la formazione della struttura secondaria. Per questo motivo
abbiamo proteine che hanno struttura differente in funzione del tipo di
aminoacidi presente. La struttura a foglietto beta si presenta come un
ripiegamento più ordinato a zig zag i gruppi alchilici risultano proiettati
sopra o sotto il piano della molecola. Più strutture di questo tipo si possono
aggregare parallelamente formando una super struttura secondaria. Possiamo
avere anche una struttura a ripiegamento beta, dove le interazione tra
il gruppo acido e basico avviene ogni tre aminoacidi.
3.
la struttura terziaria è dovuta a residui lontani a ritrovarsi avvicinati e quindi
legarsi mediante legami ad idrogeno o forze di attrazione elettrostatica. I
gruppi idrofobici della molecola vengono segregati all’interno della struttura.
Si possono formare legami zolfo zolfo tra i residui di cisterna.
4.
struttura quaternaria molte proteine sono formate da subunità, catene proteiche a
forma globulare ovvero ripiegate in se. In questo caso abbiamo delle vere e
proprie macro condensazioni e la struttura che si forma viene detta quaternaria.
L’emoglobina è un esempio di struttura quaternaria. Si parlerà di siti
allosterici che in funzione del loro compito saranno siti attivatori e
inibitori allosterici.
I legami che intervengono nelle strutture delle proteine sono di
natura:
-
legami covalenti legami ammidici, ponti di solfuro, responsabili della struttura
primaria e terziaria
-
legami a idrogeno responsabile della struttura secondaria, terziaria e
quaternaria
-
interazioni ioniche possono essere repulsive o attrattive responsabile della struttura
terziaria e quaternaria
-
interazione idrofobiche responsabile della struttura secondaria.
Classificazione delle proteine:
Classificazione in funzione alla loro attività biologica
-
Enzimi si tratta di una vasta classe di proteine che agiscono come dei
catalizzatori
-
Proteine di riserva sono proteine che
servono a nutrire gli embrioni
-
Proteine di trasporto sono dei vettori ad esempio l’emoglobina
-
Proteine protettive come gli anticorpi molecole che sono in grado di proteggere
l’organismo dall’invasione di determinate molecole
-
Tossine proteine che vengono sintetizzate da sostanze estranee, ed
hanno una elevata tossicità per l’organismo che ne viene colpito.
-
Proteine regolatrici regolano le varie attività cellulari.
-
Proteine strutturali servono per formare tessuti di sostegno
Classificazione in funzione alle loro proprietà
-
Proteine semplici per idrolisi danno luogo agli aminoacidi tipo le albumine
globulina, prolamine, proteine basiche.
-
Proteine coniugate sono legate a gruppi di natura non proteica chiamato gruppo
prostatico.
-
Proteine derivate da prodotti dell’idrolisi acida, basica, enzimatica.
Attività
di laboratorio:
Differenti esperienze si possono eseguire in laboratorio sulle
proteine.
Analisi delle proteine presenti negli
alimenti:
Prendere una piccola porzione di alimento omogeneizzare
con un poco di acqua, se la soluzione è torbida filtrare quindi aggiungere
qualche goccia dei reattivi scaldando su
bagnomaria per qualche minuto. In presenza di proteine avviene una colorazione
che varia dal viola all’azzurro, in funzione della provenienza delle proteine
animale, vegetale. Il reattivo è formato dalla soluzione A del reattivo di
Fehling allo 0,5% e idrossido di sodio
al 2%.
Separazione degli aminoacidi e delle proteine con elettroforesi:
Si possono utilizzare come fonte proteica il bianco d’uovo,
oppure vegetali, oppure animali, disgregare le proteine in ambiente basico con
una concentrazione 5 N, per un tempo di
5 - 6 ore, neutralizzare con acido cloridrico, aggiungere al preparato carbone
vegetale, filtrare e concentrare sino a 50 ml. La soluzione che si ottiene
contiene aminoacidi derivati dalle
proteine. Si prepara lo strumento per l’ elettroforesi, le soluzioni tampone a
pH =6,1 e pH = 8,5, si preparano le strisce di carta da filtro, quindi si
depongono una serie di aminoacidi di riferimento e si procede all’elettroforesi
con 350 V per circa 1 ora. Alla fine della corsa si asciugano i fogli di carta
in stufa a 100°C, quindi si spruzzano le lastrine con ninidrina il tutto in stufa
a 100°C per asciugare le lastrine. Si formano delle macchie di colore marrone,
si calcolano gli Rf, una seconda analisi mette invece le proteine che sono
state idrolizzate, stessa corsa si calcolano gli Rf e si confrontano con gli
aminoacidi noti; si passa quindi alla valutazione quantitativa del tipo di
aminoacidi presenti nella proteina.
Separazione
degli aminoacidi utilizzando cromatografia su carta
Si possono separare una miscela di aminoacidi utilizzando la
cromatografia su carta. Si preparano le strisce di carta specifica per la
cromatografia, si procede alla semina degli aminoacidi di riferimento, si
prepara la miscela eluente formata da alcol butilico, acido acetico glaciale,
acqua in rapporto 6:2:3. Si esegue la corsa, alla fine si mette la strisca in
stufa ad asciugare, si spruzza una soluzione di ninidrina, il tutto in stufa ad
asciugare e si calcolano gli Rf degli aminoacidi noti. Si passa alla semina
delle proteine dissociate ad esempio quelle dell’analisi precedente, si
calcolano gli Rf e si confrontano con gli aminoacidi noti. Si calcola la
quantità di aminoacidi presente nella proteina naturale.
Separazione
degli aminoacidi utilizzando cromatografia su strato sottile
Stessa procedura della precedente ma si utilizza la TLC. La
miscela eluente è formata da alcol butilico, acido acetico glaciale e acqua in
rapporto 4:1:1, il reattivo è una soluzione di ninidrina.
Da queste tre metodiche si possono trarre le seguenti
considerazioni: che differenza esiste tra le metodiche eseguite, quale sensibilità
hanno i tre metodi di analisi, quale è
il tempo di analisi. Cercare quindi di capire quando utilizzare una metodica
rispetto ad un'altra.
Separazione
dei fosfolipidi mediante cromatografia su strato sottile
Utilizzando l’uovo è possibile fare la cromatografia dei
fosfolipidi dal rosso. Utilizzare una
lastrina attivata deporre i campioni precedentemente trattati; la soluzione
eluente è formata da cloroformio, metanolo, acido acetico acqua in rapporto 80: 10: 6: 4.
La lastrina alla fine della corsa viene irradiata con radiazione UV per
visualizzare le macchie. La miscela per
lo sviluppo è formata da 20 g di solfato di ammonio al 20% , 100 ml di acqua e
3 ml di acido solforico concentrato. Il tutto in stufa a 200°C per circa 30
minuti. Si formano macchie di colore marrone scuro. Si calcolano gli Rf che sono riassunti nella tabella sotto
riportata:
|
Molecole |
R f |
|
Lecitine |
0,4 |
|
Fosfatidiletanolammine |
0,9 |
|
Sfingomieline |
0,2 |
Altre analisi utilizzando campioni come la caseina del latte. Tutte queste analisi debbono fornire agli allievi notizie utili sulla manipolazione delle proteine, potendo verificare le possibilità tecniche per descrivere tutta una serie di proprietà di molecole naturali. Oltre allo studio teorico si passa all’applicazione pratica, utilizzando e rielaborando le informazione assunte a lezione.
Precipitazione della caseina del latte.
Si preleva circa 50 ml di latte aggiunti a 50 ml di acqua
distillata. Si scalda a 50°C si
aggiungono circa 5 ml di acido acetico al 10%, agitando. Dopo circa 10 minuti
si aggiungono 5 ml di acetato di sodio M e si porta la soluzione al
pH = 4,5. Si raffredda e si filtra lavando il bicchiere
con acqua fredda. Il precipitato si
sospende in etanolo 10 ml si filtra nuovamente
e si spreme il precipitato. Si lascia asciugare il precipitato e quindi
si passa all’idrolisi della proteine con i metodi sopra descritti. Quindi la
procedura da seguire è sempre la stessa. Si potrà variare la miscela eluente e
vedere i risultati ottenuti.
Le lezioni di teoria sui principi teorici dell’elettroforesi e della
cromatografia vengono affrontati nel corso di analisi tecnica.
Inizio pagina | Pagina
precedente