Il mondo dell’atomo e delle molecole
Esaminando la tavola periodica si può osservare che i periodi sono 7 ovvero quanti
sono i livelli energetici dell’atomo. Definizione un poco precipitosa per
comprenderla. Allora partiamo dalla scoperta delle particelle subatomiche.
Nel 1795 Alessandro Volta realizza un dispositivo che
produce energia elettrica da una comune reazione chimica. Il dispositivo era
formato da dischi di zinco e rame impilati uno sull’altro separati da un pezzo
di feltro imbevuto in una soluzione di acido solforico, collegando il tutto con
un filo metallico si verificava un flusso di cariche elettriche. Nel 1831 Faraday scoprì la relazione tra fenomeni
elettrici e fenomeni magnetici, in quanto cariche elettriche in movimento
oscillante generano un campo magnetico. Ma arriviamo al 1858 Geissler riuscì a costruire un tubo di vetro nel quale
vennero introdotti gas a bassissime pressioni.
Scoperta dell’elettrone
Nel 1860 Crookes
effettuò esperienze con il tubo di Geissler inserendo nel tubo due lamine
metalliche, collegandole ad un generatore di corrente continua ad elevato
potenziale circa 30.000 V Scoprì che si generava una luce con colori diversi in
funzione del gas che usava. Questa luce partiva dal catodo polo negativo e
fluiva verso il polo positivo anodo. Per circa 30 ani compì esperienze alla
fine questi raggi vennero chiamati raggi catodici e sono formati da corpuscoli
di materia capaci di muovere un mulinello posto sul loro cammino, la
velocità è funzione del potenziale applicato agli elettrodi, hanno scarsa
penetrazione, hanno carica negativa.
Thomson nel 1895 lavorò sui raggi catodici
e constatò come applicando un campo magnetico ed elettrico calcolò il rapporto
tra la carica elettrica e la massa che era uguale a 5,273*1017 unità
elettrostatiche/g . Queste particelle vennero chiamate elettroni. Nel 1909 Millikan calcolò la carica elettrica dell’elettrone
che era pari a 4,803*10-10. Fu quindi possibile calcolare la massa dell’elettrone che era di 9,109*10-
Scoperta del protone
Nel 1896 Goldstein un
fisico tedesco modificando il tubo precedentemente usato scoprì che vi erano
particelle caricate con carica positiva, che chiamò raggi anodici. Oltre alla carica il rapporto fra la carica e
la massa dipende dalla natura del gas. Il massimo valore di questo rapporto si
otteneva quando si usava l’idrogeno. Thomson dedusse che quando si usava
idrogeno si generavano particelle cariche positivamente chiamate protoni, di
massa 1836 volte più grande dell’elettrone con carica uguale a quella
dell’elettrone ma di segno algebrico contrario. Perché l’idrogeno fu
scelto, perché l’idrogeno contiene un solo protone è l’elemento più leggero.
Nel 1897 Thomson propose il suo modello atomico una specie di panettone dove
dentro c’erano cariche positive e negative.
Nel 1913 Moseley scoprì che i raggi X frutto della liberazione di
elettroni in un tubo catodico, era diversa e funzione della lamina di metallo
che utilizzava. Questo faceva supporre che potevano esserci elettroni con
energie differenti. Quindi gli elementi avevano un numero di elettroni
crescenti così per il numero di protoni. Per questa ragione il numero di
protoni fu chiamato numero atomico e si indica con la lettera Z.
Scoperta del neutrone
Per la scoperta di questa nuova particella si arrivò partendo da
molto lontano. Nel 1896 Becquerel facendo esperimenti sui sali di uranio
scoprì che questo metallo emetteva delle radiazioni invisibili capaci di
impressionare una lastra fotografica. Nel 1899 Marie Curie isolò dai
sali di questo metallo un elemento il radio il quale aveva la capacità di
emettere radiazioni molto più intense dell’uranio. Il fenomeno viene
chiamato radioattività. Nel 1910 Rutherford ideò uno strumento chiamato fucile
atomico formato da piombo al cui interno fu introdotto un pezzo di sale
di uranio le radiazioni venivano sottoposte ad un campo elettrico, per la rilevazioni
dei raggi utilizzò una lastra fotografica. Egli riuscì ad individuare tre tipi
di radiazioni detti: raggi alfa, beta e gamma. I raggi alfa
venivano deviate dalla piastra negativa mostrando di essere positivi; i raggi
beta venivano deviati dalla piastra positiva dimostrando di essere negativi,
quelli che non venivano deviati non avevano carica elettrica ed era i raggi
gamma.
I raggi alfa sono carichi positivamente, hanno
scarso potere penetrante, di velocità inferiore a quella della luce di ben 20
volte. La massa è molto grande almeno 4 volte maggiore di quella del protone,
di carica elettrica doppia di quella del protone.
I raggi beta sono cariche negativamente, elevato
potere penetrante di velocità elevata. La carica e la massa è pari a quella dell’elettrone.
I raggi gamma sono neutri di elevato potere
penetrante, di velocità pari a quella della luce, di natura elettromagnetica.
Il fisico inglese nei suoi esperimenti posizionò il fucile atomico
in direzione di un esile lamina d’oro e lo bombardò con raggi alfa. Costruì uno
schermo di vetro ricoperto di ZnS che emetteva un lampo di luce fluorescente
tutte le volte che veniva colpito da radiazioni alfa. Vide che la maggioranza
dei raggi passava indisturbata la lamina, una piccola parte di essi veniva
respinta ed un'altra piccola parte veniva deviata. Pertanto formulò una nuova
teoria atomica dove le cariche positive recidevano nel nucleo formato da
protoni, mentre gli elettroni di pari numero ( teoria della neutralità )
ruotavano intorno al nucleo. Rutherford
calcolò attraverso i suoi esperimenti anche il raggio del nucleo. Si
deve arrivare al 1932 Chadwick scoprì bombardando un cristallo di Be con
particelle alfa una nuova particella chiamata neutrone. Priva di carica
e di massa simile a quella del protone. Questa scoperta fu importante per
definire la posizione degli isotopi elementi di massa diversa perché contengono
un numero maggiore di neutroni rispetto ai protoni ed agli elettroni. In
seguito si mise un poco di ordine ed accanto al numero atomico comparve anche
il numero di massa che è la somma del numero di protoni e neutroni contenuti
nell’atomo.
Numero atomico indicato con Z = numero di protoni nel nucleo
Numero di massa indicato con A = numero di protoni sommato al
numero di neutroni
|
2010Ne 2110Ne 2210Ne |
queste tre rappresentazioni significano che nella prima 10 neutroni
e 10 protoni, nella seconda 11 neutroni e 10 protoni nella terza 12 neutroni e
10 protoni. Diverso è il peso atomico dell’elemento. Nel 1960 per evitare
confusioni sui pesi atomici si decise di ovvero l’unità di massa atomica era
riferita all’isotopo del
Ad esempio la massa del carbonio 12 è 19,925*10-
Per determinare il peso atomico viene fatta una media della
percentuale di abbondanza degli isotopi in natura moltiplicata per il loro
peso.
|
168O |
99,759% |
15,9949 u.m.a |
|
178O |
0,037% |
16,9991 u.m.a |
|
188O |
0,204% |
17,9992 u.m.a |
|
(99.759*15,9949)+(0,037*16,9991)+ (0,204*17,9992) /100 = 15,9994
u.m.a |
||
Per questo motivo l’ossigeno presenta un peso atomico di 15,9994
u.m.a
Nel 1873 Maxwell formulò la teoria che la” luce visibile
“possiede una velocità nel vuoto di circa
E = h*v dove h =
6,626*10-34 J v =
frequenza il numero di oscillazione nell’unità di tempo. Questa quantità di
energia venne chiamata quanto di energia o fotone. La materia
assorbe o emette energia in maniera discontinua. Questa teoria però non
sconfessò la natura ondulatoria della luce. Nel 1910 Einstein spiegò l’effetto fotoelettrico, quando un
fotone colpisce un elettrone la sua energia viene trasformata in parte in
energia cinetica secondo la seguente formula:
|
E = h*v = E0 + ½*m*v2 |
Ribadiamo che
1.
l’emissione degli e- avviene
solamente se si supera la soglia fotoelettrica
2.
l’energia cinetica degli elettroni
emessi è costante e dipende solo dalla frequenza della radiazione
Abbiamo parlato della frequenza parliamo anche di lunghezza d’onda
come la distanza che c’è tra le due ampiezze massime.
Nel 1913 Bohr formulò una nuova teoria atomica che si riassume:
1.
l’atomo di idrogeno descrive orbite
circolare intorno al nucleo senza perdere energia.
2.
le orbite possiedono valori di energia
ben determinati.
3.
eccitando un atomo gli elettroni più
esterni assorbono energia sotto forma di quanti, saltano su orbite ad energia
maggiore. L’energia emessa avviene per quantità discrete e corrisponde al salto
quantico,
4.
il numero quantico principale contiene i
livelli di energia quantizzata e ben definita dalle regole della fisica
quantistica, dove:
|
n = m*v*r*2*P/h |
Il livello è dato dal momento angolare
dell’elettrone essendo l’orbita circolare fratto per la costante di Planck.
L’atomo è formato da sotto livelli che
conferiscono la forma dei sotto livelli il 3 numero quantico magnetico descrive
l’orientazione nello spazio dell’orbita. Il numero di spin che rappresenta i
versi di rotazione su sé stesso uno verso destra l’altro verso sinistra.
L’energia posseduta da un elettrone è il 50% di quella posseduta dall’orbita.
Ma questo era in contrasto con le leggi della fisica. L’elettrone trottola non
poteva esistere, perché girerebbe ad una velocità maggiore di quella della luce
cosa impossibile. Si passò così alla teoria dell’elettrone come onda nel 1926
Schrodinger elaborò un’equazione differenziale che poteva rappresentare la
dislocazione degli elettroni. Si parlò di orbitali atomici
I numeri quantici sono 4
|
n = 1…7 l = n – 1 descrivere la forma degli orbitali m = -l
0 + l s = +- ½ |
Visto che il concetto di orbitale trottola non
è più accettato per i motivi sopra esposti, l’orbitale è rappresentato con
un’equazione onda ovvero si ammette che la nube elettronica con struttura
tridimensionale è carica di elettricità negativa ed avvolge il nucleo, si
comporta come un magnete lungo una direzione preferenziale. L’onda può assumere
nei confronti delle linee di forza di un campo magnetico 2 sole orientazioni
che vengono indicate con spin verso l’alto e spin verso il basso.
( +1/2 e –1/2 ). ½ significa che gli
orbitali sono isoenergetici.
Ora facciamo un poco di esercizi:
Problema n 1:
per n = 1 calcolare i numeri quantici
l = 0 orbitale ad
un lobo tipo s massima capienza 2 e-
m = 0
s = +1/2 e –1/2
il livello contiene solo 2 e-
Problema n 2:
per n = 2 calcolare i numeri quantici
l = 1 3 orbitali a
due lobi tipo p massima capienza 6 e-
m = -1 0 +1
s = +1/2 e –1/2
il livello contiene 8 e- 2 e- nell’orbitale s e 6 e- negli
orbitali px py pz
Problema n 3:
per n = 3 calcolare i numeri quantici
l = 2 5 orbitali a
quattro lobi tipo d massima capienza 10
e-
m = -2 -1 0 +1 +2
s = +1/2 e –1/2
il livello contiene 18 e- 2 e- nell’orbitale s e 6 e- negli
orbitali px py pz
10 e- negli orbitali
dxy
dxyz dxz dx2y2 dz2
Problema n 4:
per n = 4 calcolare i numeri quantici
l = 3 7 orbitali a
otto lobi tipo f massima capienza 14 e-
m = -3 -2 -1 0 +1 +2 +3
s = +1/2 e –1/2
il livello contiene 32 e- 2 e- nell’orbitale s e 6 e- negli
orbitali px py pz
10 e- negli orbitali
dxy
dxyz dxz dx2y2 dz2
e 14 negli orbitali f
per passare agli altri livelli bisogna tenere
conto delle distribuzione degli elettroni e fare alcune considerazioni. Per il
primo e secondo livello di energia la distribuzione è normale ovvero:
|
1s2 2s2 2p2x2p2y2p2z |
A questo punto si manifesta il fenomeno delle
sovrapposizioni delle energie questo è dovuto al raggio del livello che entra
nel livello successivo e alla maggior penetrazione degli orbitali degli
orbitali del terzo livello per cui:
dopo il secondo livello nel terzo abbiamo
|
3s23p2x3p2y3p2z |
Invece di occupare gli orbitali 3d gli
elettroni- occupano gli orbitali 4s che hanno una minore energia
degli orbitali 3d successivamente si occupano gli orbitali 4p che presentano
energia maggiore rispetto ai 4s.
|
4s23d104p2x4p2y4p2z |
Ora invece di occupare gli orbitali 4 d si
verifica nuovamente il fenomeno della sovrapposizione e della differente
distribuzione delle energie. Distribuzione sotto riportata
|
5s2 4d105p6
6s2 4f14 5d10 6p6 7s25f146d10
7p6 |
Queste regole della distribuzione sono conosciute come regala dell’Aufbau dato il numero atomico è possibile costruire la
struttura atomica e collocare l’elemento nella giusta posizione ovvero il
periodo ed il gruppo di appartenenza.
Due regole auree
Principio di
esclusione del Pauli e regola della distribuzione di Hund.
|
Il primo si enuncia: gli elettroni che appartengono ad un atomo non possono avere
gli stessi numeri quantici. Il
secondo si enuncia: 2 e- nello stesso orbitale
con spin antiparalleli esercitano una repulsione tra loro maggiore che 2 e-
con il medesimo spin, in orbitali distinti della stessa energia. |
Esercizi guidati:
Scrivere la distribuzione dell’ N7 1s2 2s2 2p1x
2p1y 2p1z
Scrivere la distribuzione dell’O8 1s2 2 s2
2 p2x 2p1y 2p1y
Scrivere la distribuzione del Na11 1s2 2s22p2x
2p2y 2p2z 3s1
Scrivere la distribuzione del S16 1s2 2s2
2p2x 2p2y 2p2z
3s2 3p2x 3p1y 3p1z
Seguendo queste regole adesso puoi rappresentare
tutti gli elementi della tavola periodica i periodi tengono conto del
riempimento degli elettroni seguendo tutte le regole appena viste, i gruppi
tengono conto del riempimento secondo i livelli energetici.
Potenziale di ionizzazione:
energia necessaria per strappare un o più
elettroni da un atomo neutro allo stato gassoso per formare un catione. Si
esprime in elettronvolt eV L’energia per
strappare il primo elettrone viene detta energia di 1 ionizzazione,
l’energia per strappare il secondo elettrone viene detta energia di 2
ionizzazione e così via. Il più interessante è l’energia di 1 ionizzazione
e segue la proprietà della periodicità degli elementi, ovvero aumenta con il
progredire del periodo.
Z P 1° I Simbolo
|
3 |
5,39 |
Li |
|
4 |
9,32 |
Be |
|
5 |
8,29 |
B |
|
6 |
11,26 |
C |
|
7 |
14,45 |
N |
|
8 |
13,61 |
O |
|
9 |
17,41 |
F |
|
10 |
21,56 |
Ne |
|
11 |
5,01 |
Na |
|
12 |
8,98 |
Mg |
Vedi la tabella che riporta i valori dei PI in
funzione del numero atomico 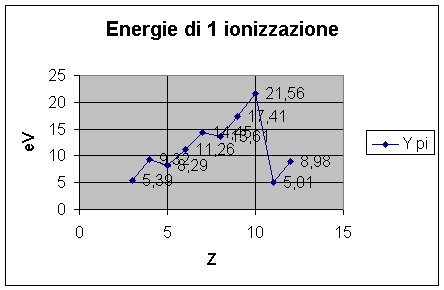
I potenziali di 1, 2, 3 ionizzazione per uno
stesso elemento aumentano. I livelli di energia tendono ad aumentare con
l’aumentare del raggio dell’atomo.
P I Potenziale di ionizzazione
|
Simboli |
PI 1 |
PI 2 |
|
Li Be B C N O F Ne |
5,39 9,32 8,29 11,26 14,53 13,61 17,41 21,56 |
76,62 18,21 25,15 24,37 29,59 35,10 34,98 41,07 |
Affinità elettronica si definisce l’energie che si libera quando un elettrone viene
associato ad un atomo neutro allo stato gassoso per formare un anione. Le
affinità elettroniche diminuiscono con l’aumentare del numero atomico
dell’elemento nello stesso gruppo. Misurata per gli elementi alogeni ossigeno e
carbonio. Più gli elettroni si allontanano dal nucleo e meno sono attratti
dalle cariche positive dei protoni.
|
Simbolo |
A E ( Kcal ) |
|
F Cl |
83,70 85,10 79,7 |
A E Affinità
elettronica
Per finire questo primo modulo facciamo degli
esercizi:
Scrivere la distribuzione elettronica dei
seguenti elementi dato il numero atomico per ogni elemento.
Fe26 Si14 Ar18 C6 K19 Cr24 Zn30
Mg12 Rb37 Ag47 Ni28 Ne10 Be4 As33 Br35
Secondo la legge di Hund scrivere la distribuzione
elettronica dei seguenti elementi dato il numero atomico.
Li3 O6 Al13 P15 Na11 Cl17 B5 C6 Co27 Ca20 V23
Se hai delle difficoltà mi puoi
contattare all’indirizzo: itisvc2000@yahoo.it
Inizio pagina | Pagina precedente